|
熱力学物語
―第3話 偉大なる法則1
〜 熱力学の第一法則 〜
第二話では〈熱力学〉における〈仕事〉について考えてきました.いよいよ熱力学の偉大なる法則の一つである〈熱力学の第一法則〉について考えていくことにしょう.
■3−1〈熱〉と〈仕事〉をつなぐ実験〈ジュールの実験〉
ジュール(Joule)は実験により〈熱量〉と〈仕事〉の関係を初めて求めています.後の正確な測定では1kcal=4.1868kJと定められています.
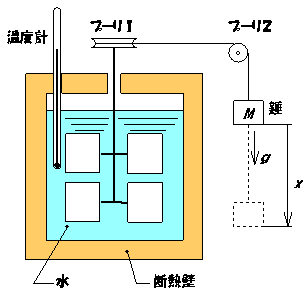
図3.1 ジュールの実験 | | ジュールは図3.1に示されるような有名な実験を行っています.この実験の概要を以下に述べます.断熱壁に覆われた円筒容器にm[kg]の水を入れ,その中に回転できる羽根車が設置されています.この羽根車の軸に取り付けられたプーリ1に巻かれた糸の端はプーリ2を介して,質量M[kg]のおもりに結ばれています.このおもりがx[m]だけ落下したとしましょう.そのとき,糸はプーリ1を介して,羽根車を回します.この羽根車の回転によって水は撹拌され,摩擦熱が発生し,水温が上昇します.この温
度上昇Δt[℃]は容器内に挿入された温度計で測定されます.
このとき,おもりがなした〈仕事〉はMgx[J],水が受け取った〈熱量〉はcmΔt=
mΔt
[kcal]であることから,1kcal=Mgx/mΔt
[J]の関係が得られます.ここに,cは水の比熱で,c=1kcal/(kgK)で与えられます.この関係を熱の仕熱当量といい,1J=
mΔt/Mgx
[kcal]の関係を仕事の熱当量といいます.
以上のことを踏まえ,「〈仕事〉も〈熱〉もエネルギーの一形態であり,〈仕事〉から〈熱〉に,また逆に〈熱〉から〈仕事〉に相互に変換される.」なる法則が導かれています.これが〈熱力学の第一法則〉なのです.
■3−2〈エネルギー保存則〉
第一話で,ピストンとシリンダによって構成された〈境界面〉によって閉じこめられた混合気や燃焼ガス(物質)を熱力学では〈系〉と呼んでいることを説明しました.図3.2に示すように,系の外側を〈周囲〉と呼んでいます.境界面は固定面でも可動面でもかまいません.この境界面を通して物質の出入りがない場合の〈閉じた系〉と,物質の出入りがある場合の〈開いた系〉に関する具体例を第二話で説明しました.
この図に示すように,エネルギーE1が〈系〉へ入り,エネルギーE2が〈系〉から出ている場合,両者の差が系内部のエネルギーの増加分ΔUとなります.すなわち,この関係は次式で与えられます.
ΔU=E1−E2
(3.1)
この関係がエネルギー保存則です.ここで,Uは〈系〉の内部エネルギーと呼ばれ,〈系〉の物質分子一つ一つの直進運動,回転運動,振動等の運動エネルギーと位置
|
|
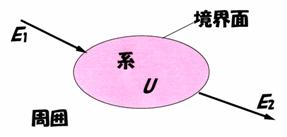
図3.2 エネルギー保存則の概念 | |
エネルギーの総和で与えられます.
式(3.1)は,〈系〉の内部エネルギーが,〈周囲〉との間にエネルギー交換が無ければ,一定で変化せず,エネルギー交換があれば,出入りしたエネルギーの差だけ増えたり,減ったりすることを意味しています.
〈周囲〉との間でエネルギー交換があれば,〈系〉の温度とか圧力とかいった状態は変化します.〈系〉の状態が1から2に変化した場合,熱や仕事はエネルギーの加えられ方によって異なる値を取りますが,温度や圧力などの状態量は各状態だけで決まる値を取り,状態変化の経路とは無関係です.
その状態量には第二話で出てきたように,〈圧力〉,〈絶対温度〉および〈体積〉が代表格ですが,それ以外に〈内部エネルギー〉,〈エンタルピー〉,〈エントロピー〉などがあります.これらの内,〈圧力〉と〈絶対温度〉は系内の物質の質量とは無関係ですが,〈体積〉,〈内部エネルギー〉,〈エンタルピー〉,〈エントロピー〉はその質量に関係し,これらの変数はすべて大文字で表します.さらに質量に関係する状態量を,質量で割ったものをそれぞれ〈比体積〉,〈比内部エネルギー〉,〈比エンタルピー〉,〈比エントロピー〉と呼んでおり,こちらの方をは小文字で表します.
系がある状態1から次の状態2へ変化した場合,状態量の変化は各状態間の状態量の差で表すことができます.例えば圧力変化は次式のように表現できます.
2
∫ dP
=
P2−P1
(3.2)
1
しかし,熱量や仕事量の変化は状態変化の経路に依存するために,以下のような表し方をしています.
2
∫
dQ =
Q12
1
2
∫
dL =
L12
1
このQ12およびL12がそれぞれ,状態変化の過程で系が外部から受けた全熱量および外部へなした全仕事量を示しています.既に,第二話で説明したように,L12には絶対仕事Lと工業仕事Ltがあります.
■3−3 内部エネルギー
ここで,図3.3に示されるように,気体がピストンとシリンダで構成される空間に閉じこめられている場合すなわち〈閉じた系〉を考えてみましょう.境界面はシリンダ内壁面とピストンの内面によって構成されます.しかし,ピストンが動けばシリンダ内壁面積は拡大もしくは縮小することになります.そこでこの移動する境界面(ピストン内面)を介してのエネルギーの出入りについて考えましょう.始めの状態1から終わりの状態2まで変化する間に,この系に周囲(外部)から加えられた熱量をQ12,系がピストンを介して周囲になした仕事をLとします.この状態変化において,Q12とLとの差Q12−Lはエネルギー保存則より系の内部エネルギーの増加量U2−U1に等しくなります.すなわち,
U2−U1
= Q12
−L
変形すると,
Q12
= U2−U1
+L [J]
(3.3)
この式(3.3)が,閉じた系の熱力学の第一法則と呼ばれています.
この考え方を系の状態の微少変化に適用してみましょう.すると微小変化の間に系に加えられた熱量dQ,外部になした仕事dLおよび内部エネルギーの増加量dUの間に以下のような微分形の熱力学の第一法則が導かれます.
dQ
=
dU
+dL [J]
(3.4)
ここで,式(2.5)の関係,dL=PdVが成り立つことより,式(3.4)は次式のよう
|
|
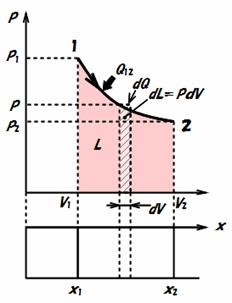
図3.3 閉じた系 | |
に書き換えられ,熱力学の第一基礎式とも呼ばれています.
dQ
= dU +PdV [J]
(3.5)
系内の気体1kg当たりについて考えるときは以下のように質量で割る形になるので前述のように小文字で書きます.
dq
= du +Pdv [J/kg]
(3.6)
熱力学の第一法則においては,系に加えられる熱量を正,系から外に捨てられる熱量を負,また系から周囲になした仕事を正,周囲から系になされた仕事を負としています.
■3−4 エンタルピー
次に,図3.4のようにヘッド部に吸入弁Aと吐出弁Bを有するシリンダとピストンで構成されている開いた系について考えましょう.この系に流入する気体と系から流出する気体の運動エネルギーの差と位置エネルギーの差が無視できるほど小さく,各物性地が時間的に変化しないものとします.
|
|
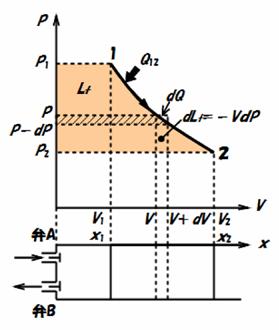
図3.4 開いた系 | |
まず,吐出弁Bが閉じ,吸入弁Aが開き,圧力P1で体積V1の気体が流入し,ピストンが始めの位置(x=0)からx1の位置まで移動したとします.このとき,系に流入したエネルギーは流体の保有する内部エネルギーU1と圧力P1でピストン(断面積A)をx1の位置まで移動させるに必要な仕事P1Ax1=P1
V1との和で与えられます.一方,この系から流出するエネルギーはピストンが外部(周囲)になす仕事はP1Ax1=P1
V1となります.
0→x1の過程で系に蓄積されるエネルギー=U1+P1
V1−P1
V1
次に,吸入弁Aを閉じて,ピストンがx2の位置まで移動したとすると,系内の気体の体積はV1からV2まで膨張したことになります.この過程でのエネルギーの出入りは,系に流入するエネルギーすなわち系に加えられる熱量Q12だけで,系から流出するエネルギーは系がピストンを介して外部になす仕事Lの他にはありません.
x1→x2の過程で系に蓄積されるエネルギー=Q12−L
続いて,吐出弁Bが開いて,圧力P2で体積V2の気体が流出し,ピストンが元の位置まで戻ったとします.このとき,系に流入するエネルギーはピストンを介して外部からなされる仕事P2Ax2=P2
V2だけになります.一方,系から流出するエネルギーは流体の保有する内部エネルギーU2と圧力P2で断面積Aのピストンをx2移動させ,元の位置に戻すに必要な仕事P2Ax2=P2
V2との和で与えられます.
x2→0の過程で系から流出するエネルギー=U2+P2
V2−P2
V2
時間的に変化しない状態(定常状態)において,流入するエネルギーの総和と流出するエネルギーの総和は等しくならなくてはならないことから,以下の関係が成り立ちます.
(U1+P1V1)+Q12+P2V2=P1V1+L+(U2+P2V2)
[J] (3.7)
式(3.7)中に流体の出入りに伴い(U+PV)の項が現れるゆえ,以下の様に表現されます.
H=U+PV [J]
(3.8)
新しく定義される物理量Hを〈エンタルピー〉と称しています.エンタルピーは式(3.8)が示すように,流体の保有する内部エネルギーと圧力Pの流体が体積Vを占めるための力学的な仕事の和であり,開いた系における流体の持つ全エネルギーと考えることができます.
流体1kg当たりのエンタルピーを〈比エンタルピー〉と呼び,小文字のh(=H/m)で表します.
h=u+Pv [J/kg]
(3.9)
このエンタルピーを用いて式(3.7)は次式のように書き換えられます.
H1+Q12+P2V2=P1V1+L+H2
[J]
さらに,以下のように書くことができます.
Q
12=(H2−H1)
−(P2V2−P1V1)+L
[J] (3.10)
ここで,式(2.10)より,Lt=L−(P2V2−P1V1)
であることから,以下のように書けます.
Q
12=(H2−H1)
−Lt
[J]
(3.11)
流体1kg当たりで表現すると次式のようになります.
q
12=(h2−h1)
−lt
[J/kg]
(3.12)
ところで,系の微小変化を表す微分形では次式のように表現できます.
dQ=dH−dLt=dH−VdP
[J]
(3.13)
dq=dh−dlt=dh−vdP
[J/kg]
(3.14)
これらの式は開いた系の熱力学の第一法則であり,熱力学の第二基礎式と呼ばれています.
ところで,等圧変化は熱力学の第二基礎式(式(3.5))で次式のように表せます.
dQ=dU+PdV
[J]
これに対して,熱力学の第二基礎式(式(3.
13))では次式のように書けます.
dQ=dH
[J]
(3.15)
すなわち,等圧変化の場合はエンタルピーを用いて表せば式が簡単になります.
予告編 偉大なる法則1〜熱力学の第一法則
第三話では〈熱〉と〈仕事〉の関係,〈エネルギー保存則〉,〈内部エネルギー〉および〈エンタルピー〉といった熱力学的な専門用語の定義をした上で,〈熱力学〉における重要な法則の一つである〈熱力学の第一法則〉について考えてきました.次回は〈理想気体〉の状態方程式,比熱および混合気体の性質等について考えて行きましょう.
(つづく) |